Quels sont les enjeux
d’une PLAIE STAGNANTE ?
D’après une interview avec le Docteur Bruno Dell’Isola,
Chef de service de Médecine Interne,
Hôpital Suisse de Paris

Qu’est-ce qu’une plaie stagnante ?
Une plaie stagnante est une plaie qui ne cicatrise pas de façon attendue avec un traitement standard. La stagnation des plaies concerne aussi bien les plaies aiguës que chroniques 1. Malgré des différences selon l’étiologie de la plaie, il existe désormais un consensus quant à une définition plus précise, selon laquelle toutes plaies répondant aux deux conditions suivantes sont considérées comme stagnantes : 2,3
 La réduction de la surface de la plaie est inférieure à 40 % après quatre semaines de soins appropriés;
La réduction de la surface de la plaie est inférieure à 40 % après quatre semaines de soins appropriés; La plaie ne peut pas être fermée par une procédure simple comme une suture ou une greffe de peau.
La plaie ne peut pas être fermée par une procédure simple comme une suture ou une greffe de peau.
La stagnation des plaies est un phénomène fréquent qui mérite une attention particulière. Une étude menée sur un échantillon de 1000 plaies réparties sur 5 pays a révélé que près de 36% des plaies ont connu une stagnation ou une dégradation. Les ulcères de jambe sont les plaies stagnantes les plus fréquemment rencontrées (44%) 4. De plus, la prévalence des plaies difficiles à cicatriser devrait augmenter en raison des niveaux croissants d’obésité, de diabète sucré, de maladie artérielle périphérique, de l’immobilité et du vieillissement 5. La stagnation des plaies entraîne non seulement un fardeau accru pour les patients, mais aussi pour la société et l’économie. Son impact financier est important avec un surcoût estimé à 135% au Royaume-Uni 6.
Comment diagnostiquer une plaie stagnante ?
D’après une approche validée par un consensus d’expert, la gestion d’une plaie stagnante se fait en 10 étapes, seules les deux premières étapes sont détaillées ici. 2
1. Évaluation holistique du patient : besoins physiques, psychologiques, spirituels et sociaux. Cela doit inclure et identifier la/ les causes physiopathologiques sous-jacentes et le/les facteurs de risque : 1,2,7,8
 Facteurs liés au patient (ex : âge > 60 ans, anémie, déshydratation, diabète sucré, prise de médicaments anti-inflammatoires ou cytotoxiques, immunosuppression, carences nutritionnelles (vitamines, minéraux), radiation, tabagisme, une perfusion réduite, maladie vasculaire périphérique, la malignité, la défaillance d’organe, facteurs psychologiques,mobilité réduite),
Facteurs liés au patient (ex : âge > 60 ans, anémie, déshydratation, diabète sucré, prise de médicaments anti-inflammatoires ou cytotoxiques, immunosuppression, carences nutritionnelles (vitamines, minéraux), radiation, tabagisme, une perfusion réduite, maladie vasculaire périphérique, la malignité, la défaillance d’organe, facteurs psychologiques,mobilité réduite), Facteurs liés à la plaie (ex : emplacement anatomique et condition du lit : infection, tissu nécrotique, œdème…)
Facteurs liés à la plaie (ex : emplacement anatomique et condition du lit : infection, tissu nécrotique, œdème…) Facteurs de compétence clinique (ex. compétences et connaissances du professionnel de santé)
Facteurs de compétence clinique (ex. compétences et connaissances du professionnel de santé) Facteurs liés aux ressources et au traitement (ex. disponibilité et pertinence)
Facteurs liés aux ressources et au traitement (ex. disponibilité et pertinence)
La physiopathologie sous-jacente de la plaie est identifiée grâce aux antécédents du patient et aux procédures de diagnostic. Lors de l’évaluation d’une plaie stagnante, il est nécessaire d’évaluer l’état vasculaire en utilisant des méthodes telles que la palpation du pouls, l’indice de pression cheville-bras, la coloration des orteils et l’imagerie doppler et radiologique si on suspecte une ostéite sous-jacente.
Si une maladie artérielle périphérique est suspectée, il est important d’adresser le patient à un spécialiste vasculaire avant de procéder au débridement et à la compression. L’œdème, qui peut être lié à la physiopathologie sous-jacente ou à des comorbidités telles que l’insuffisance cardiaque congestive, l’insuffisance lymphatique ou à des médicaments, doit être évalué. La neuropathie doit être évaluée pour les ulcères du pied liés au diabète. Une attention particulière doit être portée à la distinction entre une escarre du pied chez une personne diabétique et un ulcère du pied diabétique. 2

2. Évaluation de la plaie.
La méthode principale pour évaluer une plaie et sa cicatrisation est une observation clinique rigoureuse et une évaluation prolongée et continue. Les paramètres importants à évaluer sont la profondeur, le volume, l’étendue, la surface, l’exsudat (quantité et type), l’emplacement, l’apparence, la température, l’odeur, l’infection manifeste, la nécrose, voire une déformation structurelle. Il est aussi important de prendre en compte la présence et les quantités relatives des différents types de tissus dans la plaie, tels que nécrose, tissus de granulation et cellules épithéliales. Il faut également bien repérer si des structures nobles sont visibles au fond de la plaie telles que tendons et os. Enfin l’état de la peau péri-lésionnelle doit être apprécié afin de guider les choix thérapeutiques (parage chirurgical, soins de protection etc..).
La taille de la plaie peut être mesurée à l’aide de méthodes simples ou avancées, comme l’outil de gestion des plaies de Tissue Analytics 2. Troxler et al. ont examiné le potentiel de la mesure des plaies pour prédire l’état de cicatrisation difficile 8. De telles mesures peuvent être combinées avec d’autres caractéristiques de la peau péri-lésionnelle et de la plaie pour donner un score indiquant le potentiel de cicatrisation.
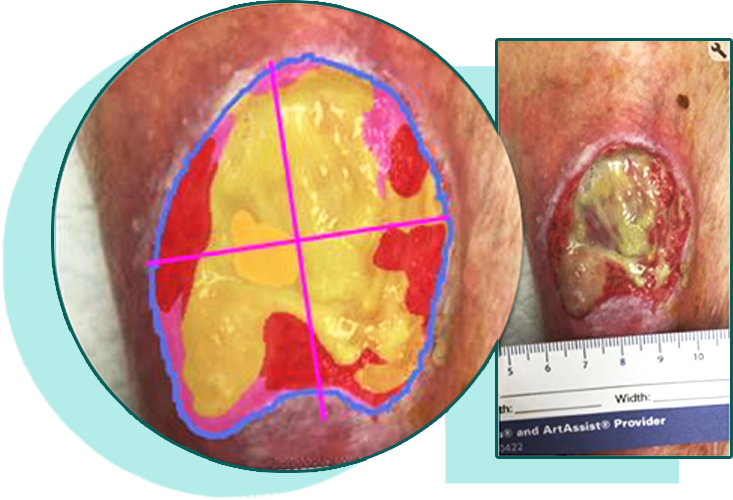
La présence de biofilm est considérée comme un facteur important dans le ralentissement de la cicatrisation des plaies stagnantes. Cependant, il est souvent difficile de diagnostiquer avec certitude la présence de biofilm sans utiliser des techniques de biologie moléculaire et de microscopie avancées, qui sont souvent coûteuses et peu accessibles pour la plupart des professionnels de la santé. Pour cette raison, un panel international a recommandé en 2019 de supposer que toutes les plaies difficiles à cicatriser contiennent du biofilm 9.
Il n’existe pas encore de tests cliniques pour prédire avec précision quelles plaies sont peu susceptibles de guérir en temps opportun. L’état nutritionnel du patient reste un facteur déterminant même si la surveillance des marqueurs inflammatoires et de la culture de la plaie, ainsi que la biopsie de la plaie, peuvent également aider au diagnostic et permettre un traitement ciblé. Chez les patients présentant des comorbidités importantes, l’optimisation de la prise en charge de la condition médicale sous-jacente peut améliorer considérablement le potentiel de cicatrisation. En outre, mesurer et agir sur les résultats de paramètres biochimiques tels que la glycémie, la fonction rénale et la fonction hépatique peut être utile. Pour certains, une détection précise d’une activité protéasique élevée ou d’autres biomarqueurs faciliterait un diagnostic précoce et l’utilisation appropriée de traitements visant à optimiser l’environnement de la plaie 1. Les niveaux de certains facteurs biologiques, tels que les marqueurs du remodelage du collagène dans les ulcères veineux et les ratios MMP-9/TIMP-1 dans les escarres ont également été associés à la cicatrisation ultérieure des plaies 8. Les cellules progénitrices endothéliales systémiques (EPC) sont également des marqueurs de guérison et de réparation (angiogenèse) 10.
Conclusion
La reconnaissance précoce et un traitement approprié sont essentiels pour traiter les plaies stagnantes efficacement. Les facteurs de risque et la physiopathologie de la plaie doivent être identifiés pour établir un diagnostic. Aussi, une observation clinique de haute qualité et une évaluation continue de la plaie doivent être menées. Une fois la stagnation de la plaie diagnostiquée, il est important :
 d’agir sur les facteurs de risque comme la dénutrition, l’équilibre d’un diabète, la gestion ergonomique des zones de pression en cas d’escarres, le port de contention aux membres inférieurs en cas d’insuffisance veineuse, une modification du mode de vie (tabagisme, obésité…)
d’agir sur les facteurs de risque comme la dénutrition, l’équilibre d’un diabète, la gestion ergonomique des zones de pression en cas d’escarres, le port de contention aux membres inférieurs en cas d’insuffisance veineuse, une modification du mode de vie (tabagisme, obésité…) et de décider du résultat souhaité (cicatrisation ou entretien) et du plan de soins, et de traiter/gérer la pathologie sous-jacente ou planifier les soins d’entretien.
et de décider du résultat souhaité (cicatrisation ou entretien) et du plan de soins, et de traiter/gérer la pathologie sous-jacente ou planifier les soins d’entretien.
BIBLIOGRAPHIE
- (1)
Vowden P. Hard-to-heal wounds made easy. Wounds Int. 2011;2(4):1-6.
https://www.woundsinternational.com/uploads/resources/8b209a588e74f81cc9dda6ed140a3c85.pdf - (2)
Atkin L, Bućko Z, Montero EC, et al. Implementing TIMERS: the race against hard-to-heal wounds. J Wound Care.2019;28(Sup3a):S1-S50.
https://www.magonlinelibrary.com/doi/epub/10.12968/jowc.2019.28.Sup3a.S1 - (3)
Matsuda T, Ohura N, Mineta K, et al. Hard-to-heal wound treatment medical devices: clinical trial protocol in Japan.J Wound Care. 2021;30(8):666-676.
https://pubmed.ncbi.nlm.nih.gov/34382845/ - (4)
Milne J, Searle R, Styche T. The characteristics and impact of hard-to-heal wounds: results of a standardised survey. J Wound Care. 2020;29(5):282-288.
https://pubmed.ncbi.nlm.nih.gov/32421485/ - (5)
Faramarzi N, Tamayol A. How can smart dressings change the future of wound care? J Wound Care. 2021;30(7):512-513
https://www.magonlinelibrary.com/doi/pdf/10.12968/jowc.2021.30.7.512 - (6)
Guest JF, Ayoub N, McIlwraith T, et al. Health economic burden that different wound types impose on the UK’s National Health Service. Int Wound J. 2017;14(2):322-330.
https://onlinelibrary.wiley.com/doi/epdf/10.1111/iwj.12603 - (7)
Cutting KF, Harding KG. Criteria for identifying wound infection. J Wound Care. 1994;3(4):198-201.
https://pubmed.ncbi.nlm.nih.gov/27922298/ - (8)
Troxler M, Vowden K, Vowden P. Integrating adjunctive therapy into practice: the importance of recognising ‘hard-to-heal’wounds. World Wide Wounds. 2006;32(1):99-105. http://www.worldwidewounds.com/2006/december/Troxler/Integrating-Adjunctive-Therapy-Into-Practice.html
- (9)
Murphy C, Atkin L, Swanson T, et al. Defying hard-to-heal wounds with an early antibiofilm intervention strategy: wound hygiene. J Wound Care. 2020;29(Sup3b):S1-S26.
https://www.magonlinelibrary.com/doi/epub/10.12968/jowc.2020.29.Sup3b.S1 - (10)
Hasan MY, Teo R, Nather A. Negative-pressure wound therapy for management of diabetic foot wounds: a review of the mechanism of action, clinical applications, and recent developments. Diabet Foot Ankle. 2015;6(1):27618.
https://www.tandfonline.com/doi/epdf/10.3402/dfa.v6.27618?needAccess=true&role=button



